Ósmosis Inversa
Introducción
El presente escrito tiene por finalidad dar a conocer el tratamiento de aguas por ÓSMOSIS INVERSA.
En estos momentos bastará con definir la ósmosis, que es la base del proceso que permitirá eliminar las sales del agua: «hacer pasar «substancias» a través de una membrana semi-permeable, sin consumo de energía exterior»
Alrededor de la Ósmosis Inversa (O.I.), hay desde que se descubrió y empezó a hablar sobre ella una controversia muy importante, por ello, creemos necesario establecer unas bases científico técnicas sobre el sistema, su utilización y los tratamientos necesarios para obtener un buen resultado.
El desarrollo tecnológico, la industrialización, el aumento de la población mundial, etc. ha provocado un aumento en la demanda de agua dulce en general y por supuesto de agua potable.
Los ríos se han ido deteriorando y lo mismo podemos decir de los acuíferos subterráneos, la calidad de las aguas freáticas ha caído de tal modo que en muchos casos es imposible utilizar dicho efluente sin un tratamiento previo, incluso para aplicaciones industriales.
Pero dado que cinco partes de la superficie de nuestro Mundo están cubiertas por las aguas cabría pensar que no tenemos problema de agua, y desde luego así será si seguimos investigando y desarrollando sistemas de reutilización, ahorro, conservación medioambiental y sobre todo sistemas de utilización del agua salada, o mejor dicho salobre, de una forma competitiva.
Es fácil entender que el coste de cualquier tratamiento de potabilización de agua salobre estará muy ligado al coste de la energía, esto implicará que en países donde la energía sea barata podremos optar por tratamientos «caros» en energía como la evaporación de aguas salobres, etc.
Pero influyen otros muchos parámetros además de la energía, disponibilidad de agua cerca, calidad del agua, tipo de proceso final, etc.
Entendamos desde este mismo momento que al referirnos a aguas salobres no lo hacemos específicamente al agua del mar, a la cual la llamaremos directamente «salada», más adelante veremos claramente los umbrales de concentraciones de diferentes contaminantes que justifican esta clasificación.
Sin lugar a dudas el tratamiento que más se ha popularizado, tanto industrialmente como para obtención de agua potable en países con gran escasez de agua, ha sido la Ósmosis Inversa (O.I.). Es un método muy sencillo en su realización, que no necesita de mano de obra especializada para su funcionamiento, que permite la amortización de las inversiones iniciales de una forma asequible, sobre todo cuando no existen opciones diferentes, y que además está por desarrollarse mucho más en un futuro muy próximo.
Hemos anticipado que se trataba de un método sencillo en su realización, e incluso como veremos bastante fácil de explicar y de entender, pero que pese a lo que mucha gente crea, incluso técnicos y científicos no especialistas, el fenómeno osmótico no está suficientemente explicado.
Existen numerosas teorías que nos aproximan al fenómeno, está perfectamente descrito y sus resultados y puesta en práctica es totalmente conocida, pero todavía no se ha dado una explicación físico-químico-técnica totalmente convincente y que permita matemáticamente modelizar el fenómeno y poder explicarlo.
Comprendemos que para muchas personas que trabajan o vayan a trabajar con equipos de ósmosis inversa, lo único que les importa es que el sistema funcione, que por un lado entra agua salobre y aplicando una forma de energía, por el otro sale agua dulce, evidentemente este modelo es simplificado pero sirve para explicar lo que ocurre diariamente en miles de lugares en los que se aplica la ósmosis inversa.
Principios Teóricos
La ósmosis natural o directa es conocida, como hemos visto, desde la antigüedad, y consiste en la disolución de un solvente (normalmente agua) y un soluto formado por uno o varios componentes químicos (sales) en disolución.
Si colocamos a un lado de una membrana agua pura y al otro lado agua con sales minerales, pasará agua pura hacia el lado de agua con sales hasta que se equilibren las presiones, la diferencia de altura manométrica entre ambos niveles es lo que conocemos como presión osmótica de la disolución.
A alguien que no conoce el fenómeno de la ósmosis y por casualidad observara este fenómeno en un equipo experimental, lo primero que le llamará la atención es que la forma en que ocurre contradice el sentido común, ya que el flujo osmótico ocurre precisamente en dirección contraria a la que se espera por comparación con los sistemas hidrodinámicos.
Si tenemos un sistema de vasos comunicantes separados entre sí por una barrera porosa seremos capaces de hacer una predicción del sentido del flujo del líquido entre los vasos.
Transcurrirá en el sentido del vaso con mayor nivel al vaso con menor nivel hasta alcanzar el equilibrio. Similar ocurriría con un sistema en el que pusiéramos en contacto dos niveles diferentes de calor, el flujo calórico iría de más a menos hasta el equilibrio.
Pero si en ese mismo experimento cambiamos en uno de los vasos el agua por agua con azúcar, es decir, por una solución, ocurrirá algo que sorprende, a pesar de que el nivel del agua sola sea menor que el del otro vaso el flujo irá desde el agua sola hacía el agua con azúcar, hasta alcanzar una diferencia de niveles en que se detendrá el flujo. Esa diferencia de niveles es la que medirá la presión osmótica.
Este es el fenómeno natural de la ósmosis. La teoría permitió plantearse qué pasaría si se aumentase la presión del lado del agua con sales (salobre), ya que si se producía el fenómeno inverso, es decir, pasaba agua limpia del lado salobre al otro (en la figura en el sentido A hacia B) dispondríamos de un sistema para eliminar sales de un agua cargada de las mismas o también para concentrar un soluto que pudiéramos precisar.
Por lo tanto si aplicamos una presión exterior, superior a su presión osmótica natural, a la solución concentrada fluye el disolvente y se produce una concentración de solutos (sales) , y en consecuencia conseguiremos disminuir la salinidad de un agua.
La presión osmótica que hay que vencer dependerá del tipo de soluto y de su concentración, como veremos más adelante, pero podemos decir que el rango de presiones estará entre 5 y 60 bar ≈ 5 y 60 Kg/cm2 ≈ 71 y 851 lbf/in2.
El fenómeno contrario a la ósmosis natural es lo que conocemos como ÓSMOSIS INVERSA.
Con este sistema se pueden realizar procesos de separación y/o concentración. Aplicada al agua, permite la separación del 95% de las sales disueltas, con lo cual logramos la reducción de salinidad de aguas salobres y de mar.
Membranas y Módulos de Ósmosis Inversa
Como se deduce de todo lo anterior la parte más importante del proceso es la membrana de ósmosis inversa (O.I.)
Básicamente son dos los materiales utilizados en la construcción de membranas semipermeables para ósmosis:
Acetato de Celulosa.
En este material se fabricaron las primeras membranas utilizadas industrialmente.
Poliamida.
Dado que los métodos de fabricación y tecnología de los materiales están avanzando considerablemente en los últimos años, se están logrando membranas de tamaño de poro y permeabilidad controlada lo cual permite la separación de substancias tanto orgánicas como inorgánicas con tamaños entre 1 y 10 å y de peso molecular muy próximos.
Las membranas de O.I. se encuentran de forma comercial agrupadas en el interior de contenedores, normalmente cilíndricos, y dispuestas en diferentes configuraciones.
Al conjunto membrana-contenedor se le denomina MÓDULO de Ósmosis Inversa.
El contenedor tiene que ser resistente a altas presiones, recordemos que las presiones de trabajo en instalaciones de tipo industrial oscilan entre los 14 y 60 bar o lo que es lo mismo 200 y 850 lbf/in2, los contenedores disponen generalmente, de tres tomas: una para el agua de entrada y otras dos para la salida del agua permeada u osmotizada y la salida de concentrados.
Las configuraciones comerciales más utilizadas son:
Tubular:
Consisten en largos tubos porosos con longitudes que oscilan entre los 1,5 y 3 m. y con diámetros entre 0,5 y 1 pulgada, los cuales llevan, concéntricamente, en su interior la membrana. El agua bruta se hace circular por el interior, recogiéndose el agua permeada entre la pared exterior de la membrana y la interior del tubo contenedor.
Fibra Hueca:
Están constituidas por miles de fibras huecas (tubos capilares) formando un haz en el interior del contenedor y cuyos extremos se insertan en un soporte de resina epoxi. El diámetro exterior de estos capilares oscila entre 60 y 80 micras para la poliamida y 200 a 300 micras para el acetato. El agua es obligada a pasar a través de la pared del capilar de espesor aproximado de 20 micras.
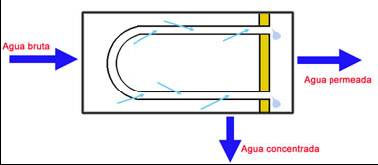
Espirales:
Consisten en hojas de membrana que se sitúan sobre un soporte poroso y un espaciador, ese conjunto se enrolla sobre un tubo de PVC que servirá como colector de agua permeada. Hoy en día el 60% de las membranas utilizadas son de este tipo.
La razón para esta popularidad son dos ventajas apreciables:
1) Buena relación área de membrana / volumen del módulo.
2) Un diseño que permite ser usado en la mayoría de las aplicaciones, admite una turbiedad más de tres veces mayor que los otros sistemas, y permite trabajar con régimen turbulento.
Según los materiales en que están fabricadas las membranas, el comportamiento respecto a diferentes contenidos en el agua o diferentes parámetros indicadores de la misma es muy diferente:
pH
La poliamida es estable dentro de una gama de pH de 3 a 11, pudiendo resistir durante cortos periodos, máximo 30 minutos, un pH comprendido entre 1 y 12.
El acetato de celulosa al ser un éster orgánico está sometido a hidrólisis con pH ácido y alcalino, por lo cual la gama de trabajo óptima se encuentra con pH entre 4 y 7.
Oxidantes
La poliamida es atacada por los oxidantes, por lo que el cloro libre superior a 0,1 ppm destruye la membrana.
El acetato de celulosa resiste la acción de oxidantes pudiendo soportar cantidades de cloro libre del orden de 2 ppm.
Temperatura
El efecto que la temperatura del agua de alimentación produce en las membranas es una característica importante a tener en cuenta para el proyecto de una instalación, ya que influye considerablemente en el rendimiento.
Los rendimientos de todos los módulos están dados en unas condiciones prefijadas de salinidad, recuperación, presión y temperatura.
Para el parámetro temperatura se consideran 25 ºC, favoreciendo el rendimiento las temperaturas altas hasta cierto límite.
Por cada grado centígrado de variación sobre la temperatura base, se producirá una disminución, en el caso de agua más fría, o un aumento, en el caso de agua más caliente, de 2,5 a 3% en el rendimiento de la instalación.
Las temperaturas máximas de trabajo oscilan entre los 30 ºC para el acetato y 45 ºC para la poliamida. El trabajar a temperaturas altas favorece el fenómeno de compactación que sufre la membrana debido a la presión de trabajo, produciendo con el tiempo una disminución de la producción.
Diferencias entre Membranas
Dependiendo de la configuración de membranas adoptadas, también existen diferencias en los rendimientos y operación.
Una diferencia fundamental entre un módulo de fibra hueca y uno en espiral es el régimen de circulación del agua por su interior, siendo éste laminar para la fibra hueca y turbulento para la espiral.
Este fenómeno tiene mucha importancia ya que en función del régimen de flujo que vayamos a tener, exigirá en el agua de alimentación grados de filtración más rigurosos para la fibra hueca que para la espiral, dado que la deposición de partículas sobre la superficie de la membrana se ve favorecida en régimen laminar.
Por otro lado, la facilidad de limpieza de las membranas en espiral es superior a las de fibra hueca pero, en cualquier caso, las que presentan mejores condiciones para la limpieza son las tubulares, pues permiten una limpieza mecánica, que se realiza con «pelotas» de esponja que se hacen circular por el interior de los tubos aprovechando la fuerza hidráulica.
Este tipo de módulos está recomendado para el tratamiento de líquidos muy cargados, como puede ser la concentración de jugos de frutas, caso típico en el que lo «aprovechable» es el concentrado.
Terminología Empleada en O.I.
Dado que en diferentes textos, catálogos, artículos técnicos, etc. se aprecian diferentes formas de denominar los mismos efectos, creemos conveniente establecer la terminología que emplearemos en nuestra gama de fabricados de O.I.
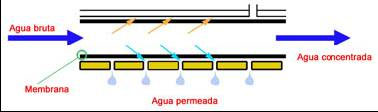
Permeado: Agua producida de baja salinidad.
Concentrado: Agua rechazada por la membrana y de mayor concentración que el agua de alimentación.
Recuperación u Obtención: Relación en porcentaje entre el volumen de agua permeada y la alimentación. Una instalación trabajando al 75% de recuperación producirá de cada 100 partes de la alimentación, 75 partes de permeado y 25 de concentrado. El valor en tanto por uno recibe el nombre de Y.
Factor de concentración: Número de veces que se concentra el agua rechazada o concentrado respecto de la alimentación.
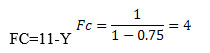
para una Recuperación del 75% (Y = 0,75)
![]()
TDS o Salinidad Total: Cantidad total de sales presentes.
Fuga de Sales o Fuga Iónica: Relación de porcentaje entre las sales del permeado y el TDS de la alimentación.

Rechazo de Sales: Porcentaje de eliminación de sales.
![]()
Rendimiento de los Módulos
La productividad de las membranas está afectada por varios factores.
1) Presión de Trabajo.
2) Salinidad del Agua de Alimentación.
3) Temperatura.
4) Tiempo de Funcionamiento.
5) Recuperación
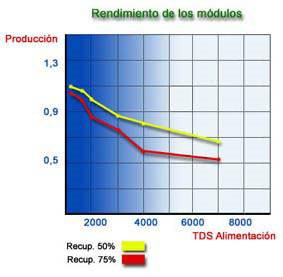
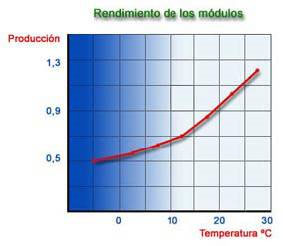
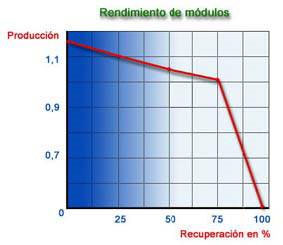
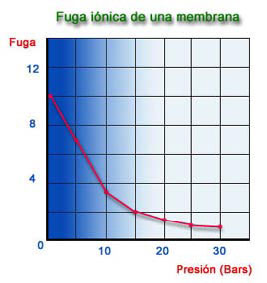
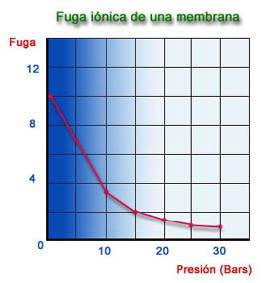
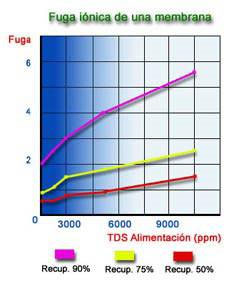
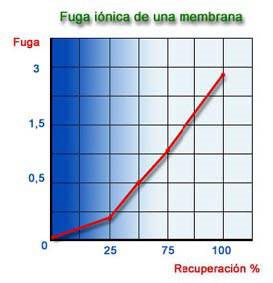
Los gráficos anteriores están calculados utilizando una membrana de fibra hueca en poliamida y en unas condiciones de trabajo de 25 ºC, 28 Kg/cm2, 1500 ppm NaCl de TDS y 75 % de Recuperación, como valores óptimos. La fuga iónica de una membrana, está afectada por tres factores:
1) Presión de Trabajo.
2) Concentración de la Alimentación
3) Recuperación.
La fuga de sales es prácticamente constante, lo que ocurre es que el caudal de permeado varía con la presión y en consecuencia se produce una mayor o menor dilución del permeado.

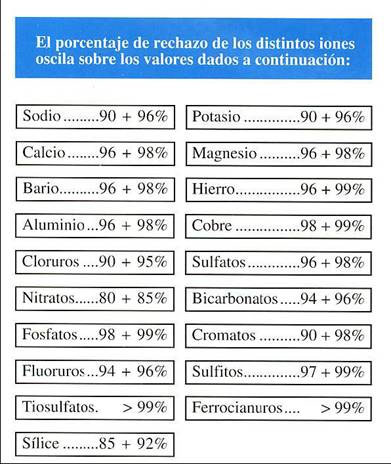
Como puede observarse, los iones monovalentes son los que más fugan. Los gases pasan inalterables por la membrana. La tabla anterior es la que figura en nuestros catálogos y es divulgativa, por ello creemos necesario incluir en este estudio dos tablas más completas sobre la eliminación de compuestos inorgánicos y orgánicos con ósmosis inversa.
| RECHAZO DE MEMBRANAS | ||||||||||||
| Inorgánicos | ||||||||||||
| Cationes | Aniones | |||||||||||
| Nombre | Símbolo | %Rechazo | Nombre | Símbolo | %Rechazo | |||||||
| Sodio | Na+ | 94 ÷ 96 | Cloruro | Cl- | 94 ÷ 95 | |||||||
| Calcio | Ca++ | 96 ÷ 98 | Bicarbonato | HCO3- | 95 ÷ 96 | |||||||
| Magnesio | Mg++ | 94 ÷ 98 | Sulfato | SO4- | 99+ | |||||||
| Potasio | K+ | 94 ÷ 96 | Nitrato | NO3- | 95 ÷ 96 | |||||||
| Hierro | Fe++ | 98 ÷ 99 | Fluoruro | F- | 94 ÷ 96 | |||||||
| RECHAZO DE MEMBRANAS | ||||||||||||
| Inorgánicos | ||||||||||||
| Cationes | Aniones | |||||||||||
| Nombre | Símbolo | %Rechazo | Nombre | Símbolo | %Rechazo | |||||||
| Manganeso | Mn++ | 98 ÷ 99 | Silicato | SiO2- | 95 ÷ 97 | |||||||
| Aluminio | Al+++ | 99+ | Fosfato | PO4- | 99+ | |||||||
| Amonio | NH4+ | 88 ÷ 95 | Bromuro | Br- | 94 ÷ 96 | |||||||
| Cobre | Cu++ | 96 ÷ 99 | Borato | B4O7- | 35 ÷ 70** | |||||||
| Níquel | Ni++ | 97 ÷ 99 | Cromato | CrO4- | 90 ÷ 98 | |||||||
| Estroncio | Sr++ | 96 ÷ 99 | Cianuro | CN- | 90 ÷ 95** | |||||||
| Cadmio | Cd++ | 95 ÷ 98 | Sulfito | SO3- | 98 ÷ 99 | |||||||
| Plata | Ag+ | 94 ÷ 96 | Tiosulfato | S2O3- | 99+ | |||||||
| Arsénico | As+++ | 90 ÷ 95 | Ferrocianuro | Fe(CN)6- | 99+ | |||||||
| ** Depende del pH | ||||||||||||
| RECHAZO DE MEMBRANAS | ||||||||||||
| Orgánicos | ||||||||||||
| Nombre | Peso Molecular | %Rechazo | ||||||||||
| Sacarosa | 342 | 100 | ||||||||||
| Lactosa | 360 | 100 | ||||||||||
| Proteínas | >10.000 | 100 | ||||||||||
| Glucosa | 198 | 99,9 | ||||||||||
| Fenol | 94 | 93 ÷ 99** | ||||||||||
| Ácido Acético | 60 | 65 ÷ 70 | ||||||||||
| Tinturas | 400 a 900 | 100 | ||||||||||
| Demanda Bioquímica de Oxígeno (DBO) | ——- | 90 ÷ 99*** | ||||||||||
| Demanda química de Oxígeno (DQO) | ——- | 80 ÷ 95*** | ||||||||||
| Urea | 60 | 40 ÷ 60 | ||||||||||
| Bacterias y Virus | 5.000 ÷ 100.000 | 100*** | ||||||||||
| Pirógenos | 1.000 ÷ 5.000 | 100*** | ||||||||||
| **Depende del pH | ||||||||||||
| ***La legislación obliga a desinfectar con un oxidante químico | ||||||||||||
Según se constata en los gráficos anteriores, si aumentamos la recuperación la productividad disminuye y la fuga de las sales aumenta. En la práctica esto se realiza disponiendo los módulos en etapas trabajando en serie.
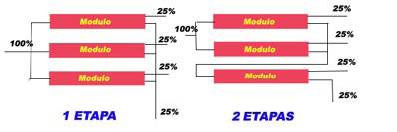
Veamos como varían los factores de concentración de 1 ETAPA a 2 ETAPAS
Para 1 ETAPA
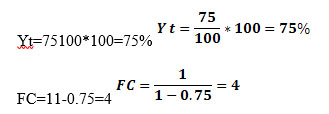
Para 2 ETAPAS
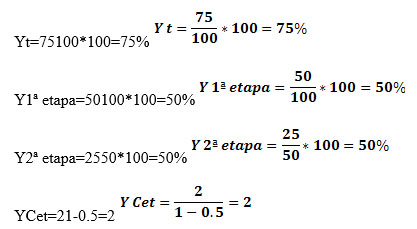
Al disponer los módulos en etapas estamos trabajando con flujo alto y baja conversión lo que disminuye la concentración de sales sobre la membrana, fenómeno conocido por «Concentración de polarización».
En resumen, la ÓSMOSIS INVERSA es un proceso en el cual, mediante la aplicación de una presión exterior, comprendida entre 14 y 60 Kg/cm2, se fuerza al agua a pasar a
través de una membrana semipermeable produciéndose un permeado que contiene, aproximadamente, el 10% del total de sales presentes en el agua de alimentación.
El Agua y sus Contaminantes
El agua es una sustancia fundamental para la vida, pero también lo es en muchos de los procesos industriales como:
- Materia Prima de un proceso.
- Disolvente o diluyente de otras materias.
- Método de transporte para otras sustancias.
- Transporte de calor, vapor, agua caliente, agua de refrigeración.
- Como auxiliar (lavado, limpieza, etc.)
Pero como ya hemos dicho anteriormente el agua es un bien escaso, y cada vez más, el desarrollo industrial, el aumento de población, la variación de la climatología,… hace que el agua sea cada vez más escasa y nos tengamos que plantear mecanismos de ahorro, recuperación y reutilización.
Pero, además, el agua tal y como la encontramos en la naturaleza no es utilizable, normalmente, ni para bebida (potable) ni para su utilización en la industria, por lo tanto creemos importante revisar las diferentes formas en que nos encontramos el agua, sus contaminantes, los parámetros que nos permiten calificar su calidad y los tratamientos previos de acondicionamiento, siempre desde el punto de vista de utilizar en el proceso la ósmosis inversa.
Nos parece interesante, como principio, establecer una diferencia entre las aguas superficiales (de río) y las aguas subterráneas (de pozo), la tabla que viene a continuación refleja unos perfiles aproximados.
| Tipos de agua | |||
| Contaminante | Unidad | Agua de Río | Agua de Pozo |
| Temperatura | ºC | 14 | 9,5 |
| Turbiedad | UTN | 18 | 0,2 |
| Color | mg/l Pt-Co | 30 | 10 |
| Materias en Suspensión | mg/l | 25 | 0,35 |
| pH | 8 | 6,5 | |
| TAC | ºFranceses | 20 | 35 |
| meq/l | 4 | 7 | |
| TH | ºFranceses | 22 | 80 |
| m/l | 4,4 | 16 | |
| de los que
Ca |
ºFranceses |
17 |
71 |
| Mg | ºFranceses | 5 | 9 |
| Cloruros | mg/l Cl- | 25 | 70 |
| Sulfatos | mg/l SO4– | 18 | 330 |
| Hierro | mg/l Fe | 1,4 | 3,5 |
| Manganeso | mg/l Mn | Trazas | 1,2 |
| Amoníaco | mg/l NH4+ | 0,7 | 1,5 |
| Nitritos | mg/l NO2- | 0,2 | Trazas |
| Nitratos | mg/l NO3- | 3 | 1 |
| CO2 libre | mg/l | 4 | 135 |
| Oxígeno disuelto | mg/l | 9,5 | Ausencia |
| Oxidabilidad al permanganato | mg/l O2 | 7,5 | 1,5 |
| TAC = Título alcalimétrico completo (medida de la alcalinidad) | |||
| TH = Grado hidrotimétrico (medida de la dureza) | |||
Por supuesto, los valores reflejados en la tabla de arriba son simplemente orientativos, siendo útiles para cuando un posible interesado nos diga, antes de hacer el análisis, si el agua es superficial o de pozo, así sabremos más o menos qué resultados obtendremos.
Evidentemente la contaminación aguas arriba de una toma o de los mantos freáticos puede hacer cambiar sustancialmente los valores indicados.